Bigger and Better Photons: The Road to Great FLIM?Results
原文鏈接 by Wolfgang Becker
翻譯 by 譚瓅
摘要:這篇文章試圖幫助bh FLIM技術的現有和未來用戶從FLIM實驗中獲得最佳結果。第一部分解釋了TCSPC FLIM的原理,并給出了記錄的光子分布的效果。它表明,測量壽命的信噪比在優先取決于記錄的光子數量。第二部分重點介紹優化光子數,而不增加施加到樣品中的光應力。我們討論了激發功率、采集時間、采集效率、數值孔徑、聚焦精度、對準精度和探測器效率的影響。第三部分將重點介紹光子效率。它考慮了TCSPC計時參數、計數背景、像素數、儀器響應函數的影響,以及多指數衰減函數的挑戰。最后一部分專門介紹數據分析。本文中的所有結論均通過在實際條件下記錄的真實測量數據進行演示。
第三部分:最大化光子效率
如“信噪比”小節中所述,TCSPC系統能夠達到SNR = SQRT(N)的理論信噪比。然而,這要求探測到的每個熒光光子都會向結果貢獻其最大的信息量。這要求正確配置TCSPC計時(timing)參數,避免記錄背景光子,并以足夠高的精度確定光子時間,這一部分將討論這些要點。
觀測時間間隔
觀測時間間隔可以對壽命的信噪比產生影響。圖 16 顯示了一個示例,采集相同樣品的兩張圖像,采用相同的計數速率和相同的采集時間,激光重復率為50 MHz。在5 ns的觀測時間間隔內記錄了左側圖像,壽命約為2.2 ns,熒光在觀測時間間隔內不會完全衰減,見圖16,第二行左。結果,衰減函數尾部的光子沒有被記錄下來,數據分析過程只能從記錄的部分衰減確定壽命。因此,像素上壽命的分布比理想條件下更寬,參見圖16,左下角。圖 16 中所示的情況非常常見,較短的觀測時間間隔非常適用于壽命極短的樣品,然而,它們也可能無意中被用于較長的使用壽命,從而獲得欠佳的光子效率。
右側的圖像是在12 ns的觀測時間間隔內記錄的,幾乎所有的光子的衰減函數都被記錄下來,數據分析可用整個衰減函數來確定壽命,見圖16的第二行右。因此,壽命的分布(圖16,右下角)比左圖窄。
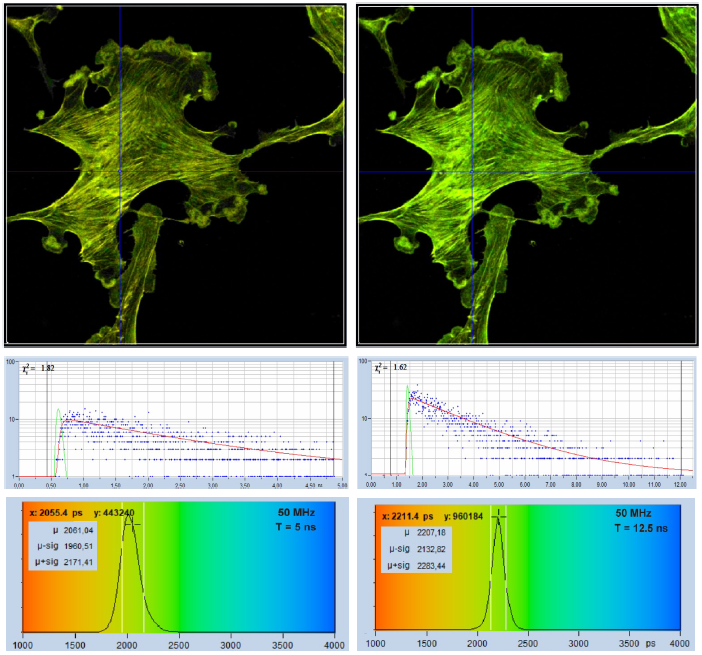
圖16:在5 ns(左)和12 ns(右)的觀測時間間隔內記錄的圖像。衰減曲線和直方圖顯示在第二行和第三行。
此外,衰減曲線在觀測時間間隔中的位置也會對光子效率產生影響。圖 17 顯示了一個示例。對于左側圖像,衰減曲線未正確放置在觀測時間窗口中,曲線向右移動,因此衰減曲線的遠端不會被記錄。圖 17(左)中參數設置中的錯誤可能看起來微不足道且易于糾正 (參考文獻[2]),但在TCSPC FLIM數據中經常遇到這種情況。
在右側的圖像中,衰減數據被完美地放置在觀測時間窗口中,并記錄了整個衰減曲線。不僅沒有光子的損失,擬合時還具有更大的時間間隔,它可以很好地用于確定壽命值。因此,正確居中的衰減數據的壽命直方圖明顯變窄,見圖17,底部。標準差 στ 為 80 ps,而左側數據的標準差為 118 ps。這是一個1.48的比率,正確居中的衰減數據更佳。στ 中 1.48 的比率可能聽起來不多,然而,它轉化為光子效率是2.18倍。這意味著錯誤配置的系統需要2.18倍的光子數(或2.18倍的采集時間!),才能達到與右側系統相同的壽命精度。
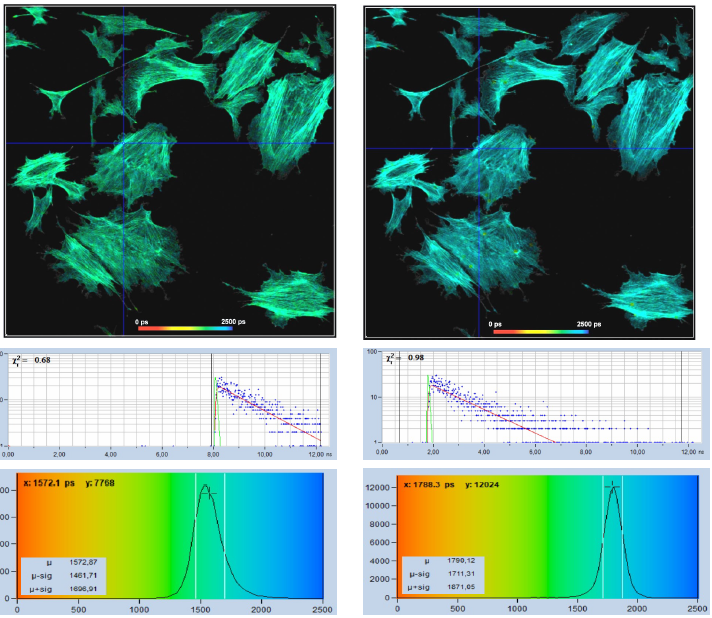
圖17:衰減曲記錄欠佳的影響。在左圖中,衰減曲線被不正確地放置在觀測時間窗口中,衰減曲線的遠端沒有記錄。在右圖中,衰減數據完美地放置在觀測時間窗口中。記錄整個衰減曲線。正確居中的衰減數據的壽命直方圖明顯更窄。
圖 16 和圖 17 中左右的壽命圖像的比較也顯示了另一個效果:
左側圖像中的壽命偏向于較小的值,原因是熒光衰減不是純粹的單指數。慢衰減分量在衰減曲線的尾部最為突出,而它在丟失的部分數據中。當數據分析過程使用單指數模型擬合數據時,它只能優化衰減數據記錄部分的擬合。在這一部分中,慢速分量的表示不足,結果是確定的壽命比實際時間短。采用一階矩技術的情況更糟,由于缺少熒光衰減的尾部,計算的矩太小,因此從一階矩得出的熒光壽命太小。
激光器重復頻率
使用ps二極管激光器的FLIM系統可以在不同的激光重頻下工作,參考文獻[5,6,7]。標準重頻為 20 MHz、50 MHz 和 80 MHz,其他重頻也可按需定制。使用Ti:Sa激光器的多光子FLIM系統以80 MHz的頻率運行,而采用飛秒光纖激光器的系統通常使用40 MHz,參考文獻 [14]。哪種重頻最好?5 ns的熒光壽命是否仍能以 80 MHz 的重頻準確測定?我是否應該總是使用80 MHz,因為它有充足的激發功率?
圖18顯示了染料溶液掃描中選定點的衰減曲線,熒光壽命為5.6 ns。上部曲線以50 MHz獲得,下部曲線以80 MHz重頻獲得,光子數約為20,000,在兩條曲線中大致相同,但這兩條曲線都包含大量來自上一個激發脈沖激發出的光子的“不完全衰減”。當然,在80 MHz的記錄中,不完全衰減的量更高,因為熒光衰減的時間更短。顯而易見,衰減不完全的數據不能用一階矩技術來分析。它們可以使用SPCImage的“不完全衰減”模型進行處理,以這種方式處理圖像會產生圖18中右圖所示的壽命分布。
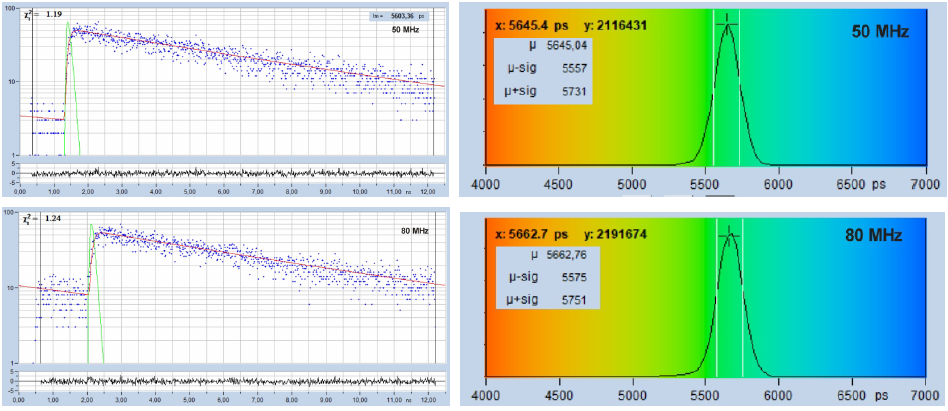
圖18:染料溶液的熒光衰減函數,5.6 ns熒光壽命。頂部:激光重復率 50 MHz。底部:激光重復率 80 MHz。左側:衰減曲線。右側:像素上壽命的直方圖。
結果是令人意外的:盡管50-MHz曲線看起來更加“分析友好”,但直方圖實際上是相同的。為什么?原因是5.6 ns衰減和另一個5.6 ns衰減的總和偏移了一個周期,仍然是5.6 ns衰減。因此,擬合程序以合理的標準偏差提供正確的壽命值。標準偏差大于20,000光子的理想值,但對于兩個記錄都是相同的。與理想記錄相比的損失來自記錄時間間隔不覆蓋整個衰減的事實,而不是來自存在不完全衰減的事實。圖 19 支持這一點,它顯示50 MHz的記錄,但在20 ns的觀測時間間隔內,壽命分布明顯更窄。
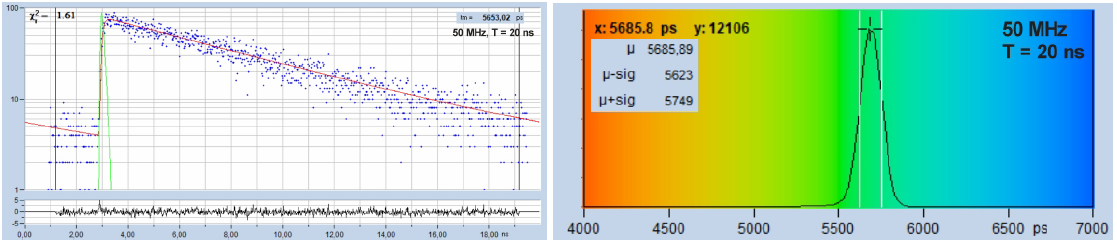
圖19:5.6 ns的熒光衰減,以50 MHz的重頻,記錄在20 ns的觀測時間間隔內。
所以結論是:如果可能的話,使用盡可能覆蓋熒光衰減的記錄時間窗口。如果因為激光脈沖周期太短而無法這樣做,不要擔心,數據分析將處理不完整的衰減,并提取最佳的壽命信息。
計數背景
計數背景不僅是FLIM數據中最常見的缺陷,也是最具破壞性的缺陷。幸運的是,這也是最容易避免的,在大多數情況下,背景只是來自日光的影響。最脆弱的是采用非解掃探測(NDD)的多光子系統,這些系統沒有針孔可以阻擋來自激發點外部的光,它們直接探測樣品散射出來的光子,從樣品表面的大面積區域收集光,這樣做的副作用是它們對環境光也很敏感。因此,必須使系統遠離日光。
圖20顯示了如果衰減數據被背景計數覆蓋會發生什么情況。熒光光子(a)的平均到達時間<t> = τ,時序噪聲為σt = τ。我們可以單獨建立熒光光子的光子分布,它將代表真正的熒光衰減曲線(a,右),以στ = τ / SQRT(N)的標準偏差提供熒光壽命,即光子效率為1。背景光子(b)在整個觀測時間窗口(T)上均勻分布,它們的平均到達時間為T/2,時序噪聲為σtbkg=0.28 T(見圖24)。
記錄過程在熒光和背景光子之間沒有區別,因此,探測到的信號(c)是熒光衰減和背景的總和。這會導致兩個不利影響:首先,平均到達時間不再是熒光衰減時間τ,相反,它是壽命τ和背景光子平均T/2的光子數加權平均值,因此,數據不能通過一階矩或基于矩的任何其他技術進行分析。
其次,有效定時噪聲是熒光光子的定時噪聲σt = τ和背景的定時噪聲σtbkd = 0.28 T的加權和。在大多數情況下,0.28 T 大于 τ,因此,它對凈標準差(測量壽命的 στmeas)有很大的影響。精確計算στmeas以及光子效率是困難的,并且提供的結果不容易解釋。上述討論表明,計數背景對探測到的熒光壽命有很大影響。
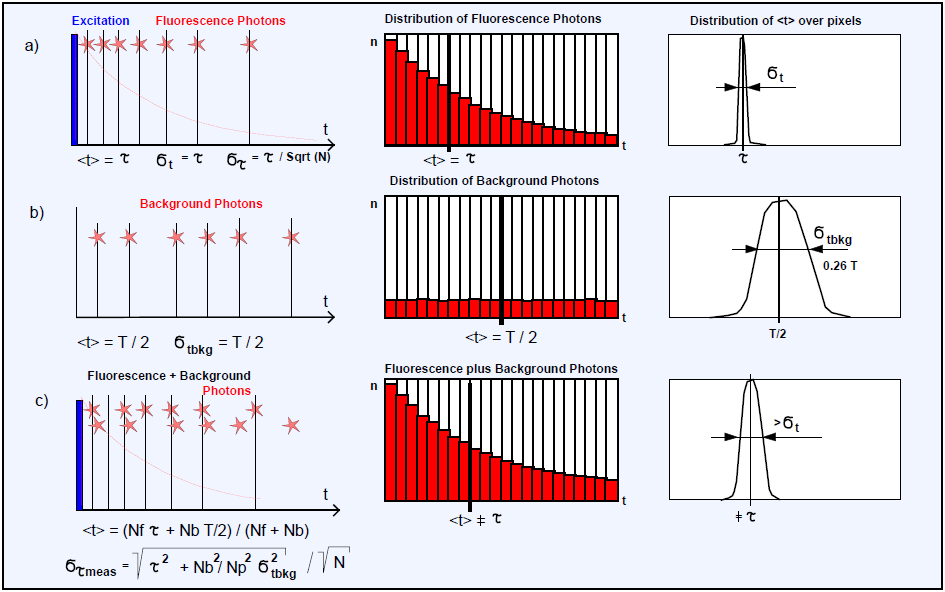
圖20:計數背景對光子時間的影響
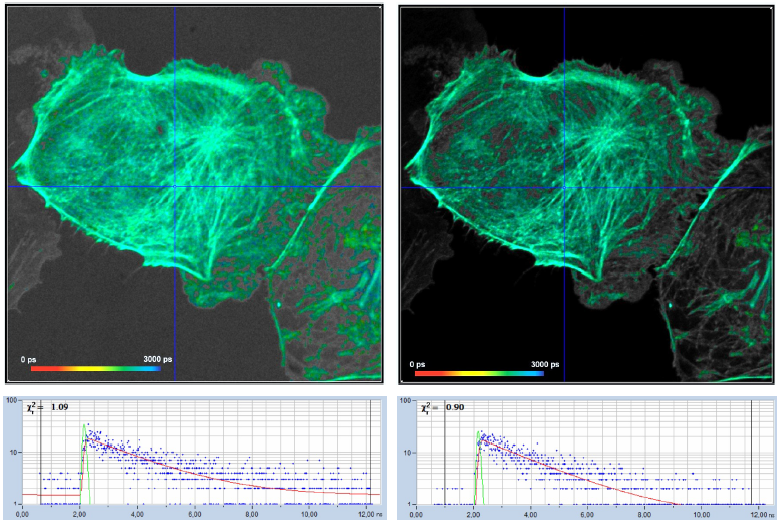
一個實際示例如圖 21 所示,來自同一樣品的FLIM圖像以帶背景(左)和不帶背景(右)記錄。在左圖中,每個像素中的背景約為900計數(所有時間通道的總和),在右圖中接近于零,最亮像素中的熒光光子數量約為4000。因此,背景明顯損害了圖像的對比度,參見圖21,左圖。然而,對比度的損失并不是那么糟糕,但圖像模糊了。右圖沒有背景,因此提供了最大的對比度。
所選點中的衰減曲線顯示在第二行中,左圖的衰減曲線包含背景計數,右圖的衰減曲線不包含背景計數。背景似乎很溫和,看起來不像是一個真正的問題,然而,對壽命準確性的影響是巨大的。這可以在圖21的第三行中看到,它顯示了每個記錄的phasor?plot圖和按一階矩計算的壽命直方圖。可以很容易地看出,左側數據組的直方圖和phasor?plot圖不僅完全偏移,而且極度展寬。原因不僅在于背景為光子數據增加了時序噪聲,還在于背景為矩增加了偏移。由于熒光信號和背景信號的比值隨像素的亮度而變化,因此壽命值被極度模糊。
 |
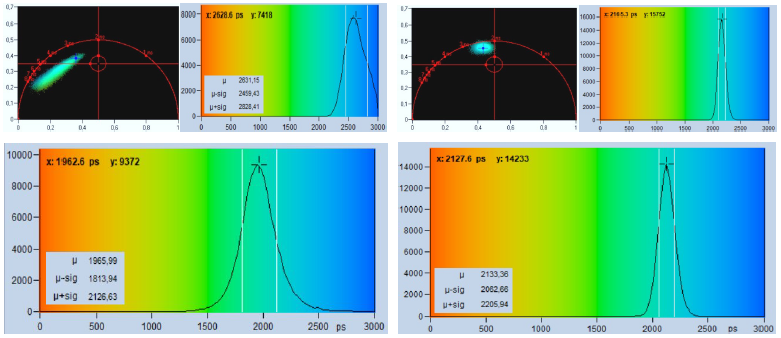 |
圖21:計數背景對FLIM精度的影響。左:帶背景計數的 FLIM 數據。右:無背景記錄。上行:圖像。第二行:所選點中的衰減數據。第三行:M1 分析的Phasor plots圖和壽命直方圖。最下行:采用 MLE 分析的壽命直方圖。
圖21的底行顯示了采用MLE分析獲得的壽命直方圖,就壽命移位而言,擬合過程比矩分析做得更好。壽命大約是170 ps,直方圖比右邊的無背景記錄寬兩倍,壽命標準偏差的兩倍轉化為光子效率是相差四倍!
時間通道數
與普遍的觀點相反,衰減曲線中的時間通道數對信噪比沒有直接影響。它沒有出現在一階矩分析推導的SNR方程(“信噪比”小節)中,并且擬合例程進行數據分析并不關心FLIM數據在兩倍的時間通道中是否只有一半的光子數量,反之亦然。只有衰減曲線中的光子總數才重要,圖22給出了實驗驗證。它顯示了一個用Alexa 488染色的樣品,在所使用的探測波長下,整個掃描區域的壽命幾乎是均勻的。第一行中的數據用64個時間通道記錄,第二行的數據用1024個時間通道記錄,圖像中的光子總數幾乎相同。正如預期的那樣,壽命直方圖(第一行和第二行,右)幾乎相同。
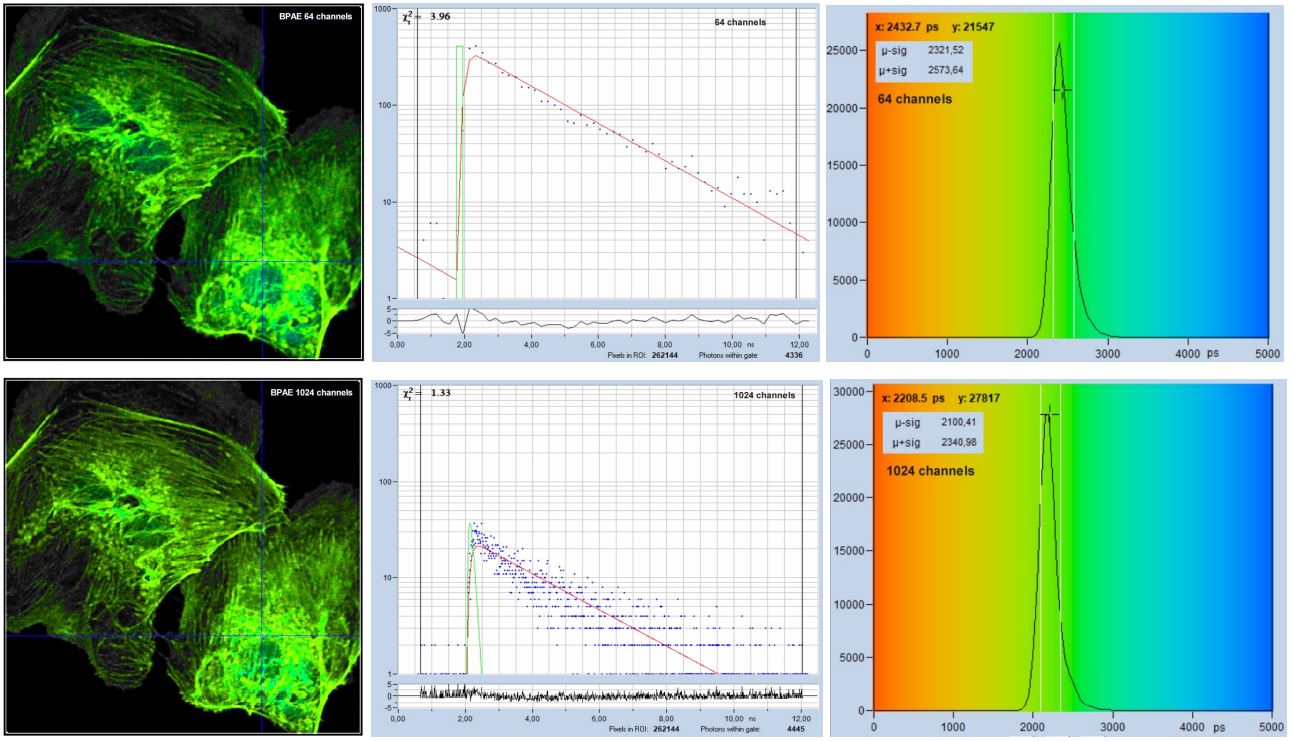
圖22:使用不同數量的時間通道,相同的光子總數進行記錄。上排:64 個時間通道。下排:1024個時間通道。從左到右:圖像,光標位置的衰減曲線,單指數擬合,像素上壽命直方圖。與普遍的觀點相反,在64通道記錄中,每個時間通道的光子數量越多,并沒表現出更高的壽命精度。
壽命的SNR與時間通道數無關,這并不意味著可以使用數量任意小的時間通道和任意大的時間通道寬度。在兩個或四個時間通道中進行探測會大大降低光子效率,參考文獻[1,10,16]。當時間通道寬度與IRF寬度的數量級相同時,SNR已經開始下降。這種情況下,不清楚IRF在第一個通道中的位置,以及熒光脈沖的上升開始的位置。這增加了壽命計算的不確定性。根據經驗,IRF和最快的衰減分量都應使用不少于5至10個時間通道進行采樣。這意味著,對于HPM-100-40探測器(IRF寬度120 ps),探測低至100 ps的快速衰減分量,時間通道寬度應約為10 ps。對于 10 ns 的觀測時間間隔,時間通道數應為 1024。對于 HPM-100-06(IRF 寬度<20 ps),將時間通道數增加到 4096(即將時間通道寬度減小到3 ps)是合理的,如果要探測超快衰減分量,采用更窄的時間通道更佳。
IRF——儀器響應函數的影響
如果 FLIM 系統的 IRF 具有非零寬度,會發生什么情況?IRF的影響可以通過觀察光子到達時間來估計。讓我們假設我們已經記錄或以其他方式確定了FLIM系統的IRF,然后,我們可以通過平均IRF測量的光子時間來定義IRF的“質心<tirf>。如圖6所示,熒光衰減時間τ是通過簡單地從平均光子時間<t>中減去<tirf>而獲得的,參見圖23,左圖。
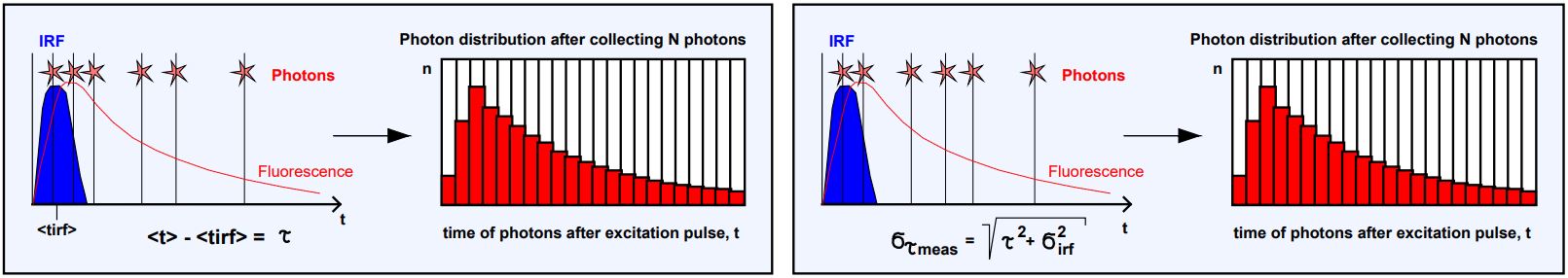
圖 23:IRF 寬度不為零的系統中壽命測量的標準偏差。左圖:壽命是光子的平均到達時間 t 減去 IRF 質心的時間,<tirf>。右圖:測量壽命的標準差 τmeas 包含 IRF σirf 的貢獻。
以這種方式獲得的壽命標準偏差是多少?可以假設標準差仍然是τ / SQRT(N):IRF的質心是準確的,減去它不會改變t的標準差,但這是不可能的,因為光子時間本身包含來自IRF的不確定性,每個熒光光子定時參考在IRF中都是不同時間。另外,它可能在激光脈沖的不同時間被激發,或者它花了不同的時間通過探測器,這增加了光子時間t的不確定性,并增加了IRF σirf對理想光子時間的標準偏差σt = τ的貢獻。
因此,測量光子乘以σtmeas的標準差大于τ,測量壽命的標準偏差στmeas大于τ / SQRT(N),可以通過下式來進行估算:
στmeas = SQRT (τ2 + σ2irf) / SQRT (N)
或
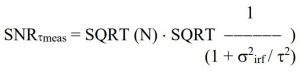
σirf也被稱為“計時抖動的RMS值”或 (有點誤導地)“IRF寬度的RMS值”。對于在實踐中遇到的IRF形狀,它大約是IRF半高寬(FWHM)最大值的0.43到0.87。圖 24 給出了幾種典型 IRF 形狀的 RMS 與 FWHM 值。對于高斯IRF,計時抖動的RMS值為0.43 FWHM。對于非對稱函數,這個值會更大。具有慢尾或帶有凸起的IRF會給衰減數據增加更多的時序噪聲,如果可能的話,應該避免使用。請注意,尾部和凸起也可能源于過高功率下工作的皮秒二極管激光器。不利的IRF形狀造成的精度損失實際上可能超過光子數量增加帶來的增益。
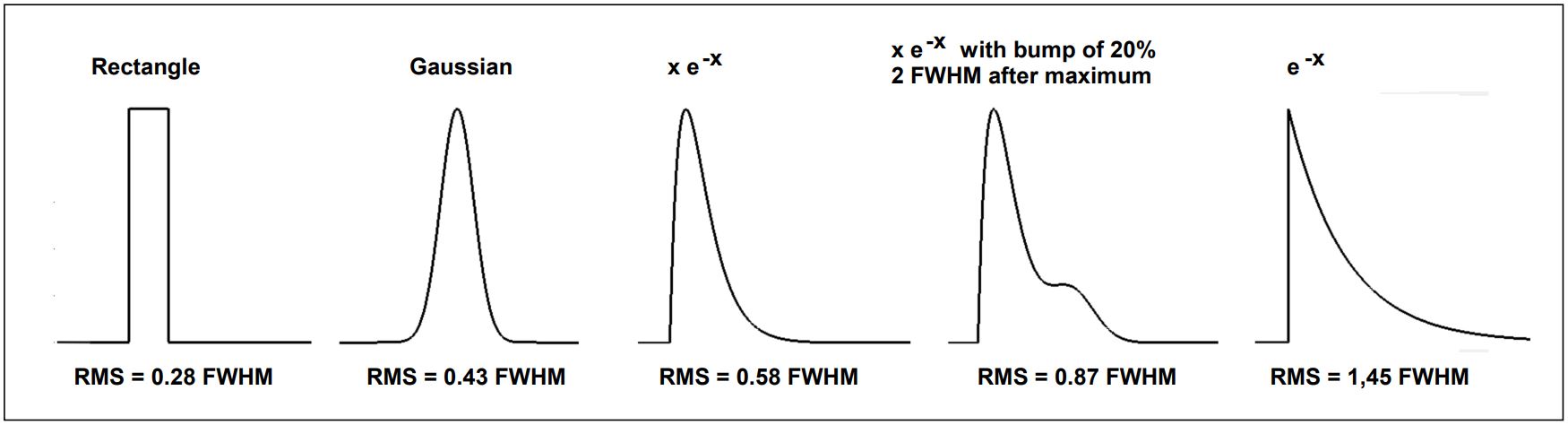
圖 24:一些典型 IRF 形狀的 RMS 值。從左到右:矩形、高斯、x?e-x、有凸起的x?e-x、指數函數 e-x 。函數歸一化為相同的FWHM,RMS值以FWHM的倍數給出。
從這個結果中可以得出兩個結論。第一個是,毫不奇怪,SNR仍然與N的平方根一起縮放。第二個是,只有當IRF寬度的RMS大于熒光壽命的約50%至100%時,SNR才會大幅下降。隨著IRF寬度的增加,壽命精度的下降緩慢。這導致了一種誤解,即FLIM系統的IRF寬度并不重要:典型熒光團的熒光壽命在幾納秒的范圍內,因此,如果 IRF 是完全已知的,則 500 ps 到 1 ns(RMS) 的 IRF 寬度應該就足夠了。然而,這與任何實際經驗相矛盾,錯誤出在哪里?
FLIM中的熒光衰減函數不是單指數的,不僅如此,所需的信息通常是在衰減函數的組成中,而不是在凈“壽命”中。在這種情況下,IRF必須比最快的衰減分量快。FRET測量和自發熒光測量中的主要衰減成分分別低至約300 ps和100 ps,參考文獻[2],HPM-100-40 探測器非常適合這些應用。在蘑菇孢子,參考文獻[12],人類頭發和哺乳動物皮膚病變中,會遇到低至10 ps范圍的壽命。這些測量需要更快的探測器。示例將顯示在“多指數衰減函數”一節中。
多指數衰減函數
當FLIM僅用作激光掃描顯微鏡中的比對技術時,熒光衰減的單指數近似值及其表觀壽命的測量可能就足夠了。然而,FLIM的真正應用是分子成像。熒光團 – 無論是內源性還是外源性 – 根據其分子環境改變其熒光壽命。這可能與蛋白質,蛋白質結構,蛋白質與其他蛋白質的相互作用,細胞或組織代謝狀態的影響,或參與細胞功能的離子濃度相結合。在這些應用中,任務不是區分不同的熒光團,而是區分不同分子環境中相同熒光團的組分,并通過其相對濃度量化它們,參考文獻[1,4,15]。在大多數情況下,這需要記錄多指數衰減函數,并將它們分成不同的衰減分量。因此,多指數衰減記錄和多指數衰減分析是生物系統的FLIM標準配置。圖 25 和圖 26 顯示了幾個示例。圖30、圖31和圖38顯示了多指數FLIM測量的更多示例。
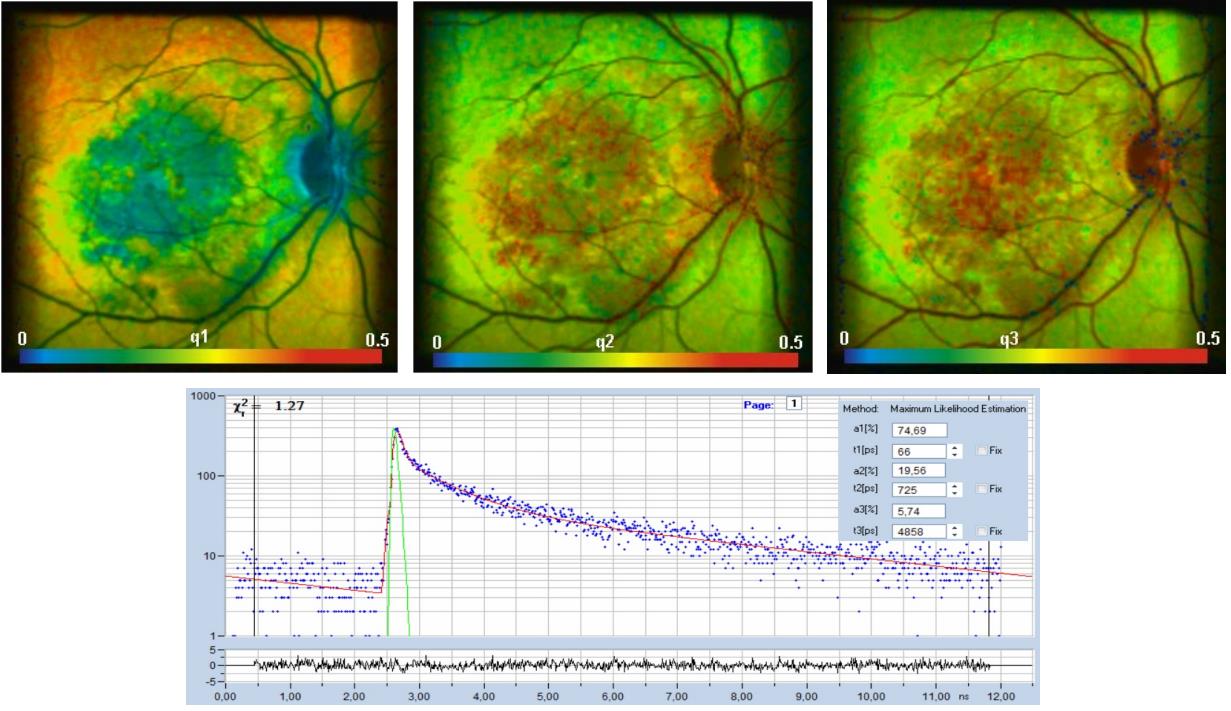
圖25:頂部:人體視網膜的FLIM圖像,在體記錄。快速、中衰減和慢衰減分量的強度貢獻。底部:圖像選定點的衰減曲線。數據由耶拿大學的Dietrich Schweitzer和Martin Hammer提供。
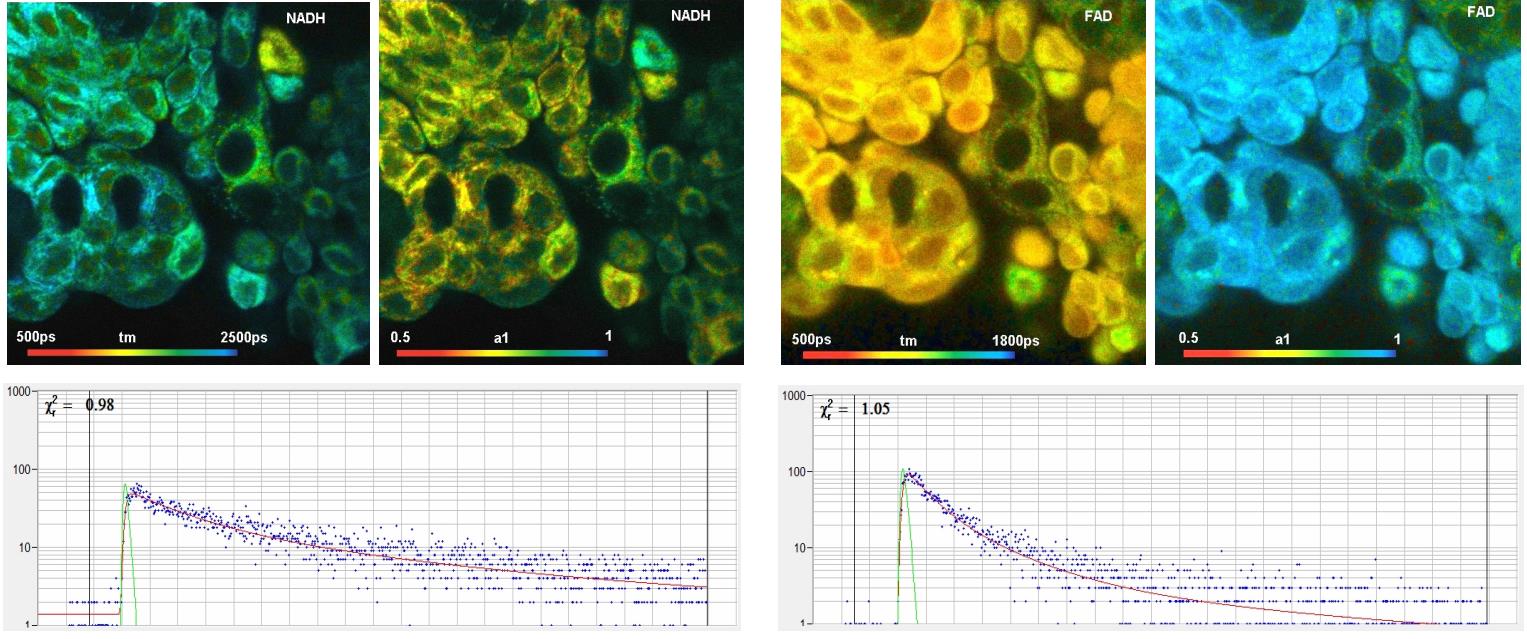
圖26:通過FLIM對NADH(左)和FAD(右)進行代謝成像。雙指數衰減的振幅加權壽命(tm)、和快速衰減分量振幅a1的圖像。底部:NADH和FAD圖像的選定點中的衰減函數。
從多指數衰減分析中提取單個衰減分量比單指數擬合或一階矩分析需要更多的光子,參考文獻[17]。因此,探測效率和光子效率是關鍵參數。時間分辨率也很重要 – 對IRF寬度的要求是由最快衰減分量的壽命決定的,而不是由凈衰減函數的表觀壽命決定的。
同樣重要的是衰減函數的形狀,它們與單指數衰減的差異越大越好。具有幾乎相同壽命的衰減分量很難或不可能分裂,參考文獻[17],低振幅的衰減分量也很難提取。圖 27 顯示了三個示例。左圖所示的函數在 2.4 ns 的背景中包含 445 ns 的 82 %。這很容易解決。中間的函數比較困難。快速分量的幅度僅為24%,壽命值接近900 ps,而慢速分量的幅度為2.5 ns。凈衰減函數比左邊的函數更接近單指數。右側的衰減輪廓在視覺上與單指數衰減無法區分。它包含35%的3 ns和65%的4.5 ns,使用FLIM中通常可用的光子數量,無法逐個像素地解析。
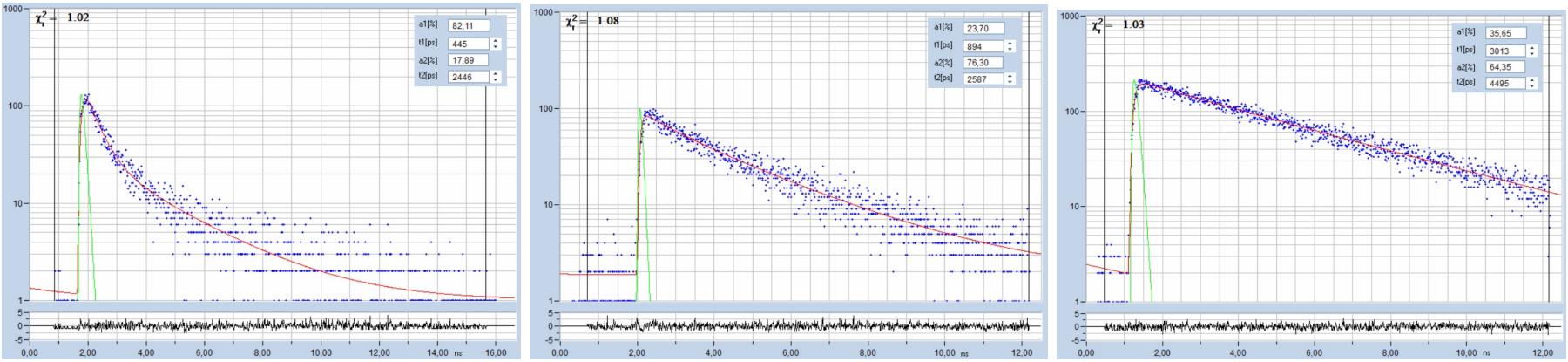
圖 27:雙指數衰減函數。左側的函數易于解析,中間的函數難以解析,右側的函數在FLIM數據中幾乎不可能解析。
圖27右所示的情況,如果可能的話,應該在實驗計劃中避免。一個例子是FRET實驗:具有大供體 – 受體重疊的FRET對,和具有短供體 – 受體距離和大比例供體相互作用的FRET結構,以大振幅和短壽命提供供體衰減函數的快速分量。這使得衰減輪廓更容易分辨,從而分離相互作用和非相互作用的供體部分。在某些情況下,如果信號利用光譜進一步分離,結果可以得到極大的改善。衰減分量的數量得以減少,分析變得更加容易。光譜分離可以在激發端和探測端獲得。一個例子是NADH / FAD FLIM的代謝成像。當兩個熒光團以相同的波長激發(正如經常嘗試的那樣)并且僅通過不同的發射濾光片觀察到時,這種情況幾乎是無望的。然而,通過在正確的波長間隔內進行多路復用激發和探測,信號可以很好地分離,參考文獻[15]。因此,在樣品設計和FLIM配置方面進行實驗規劃對結果的質量有很大的影響。
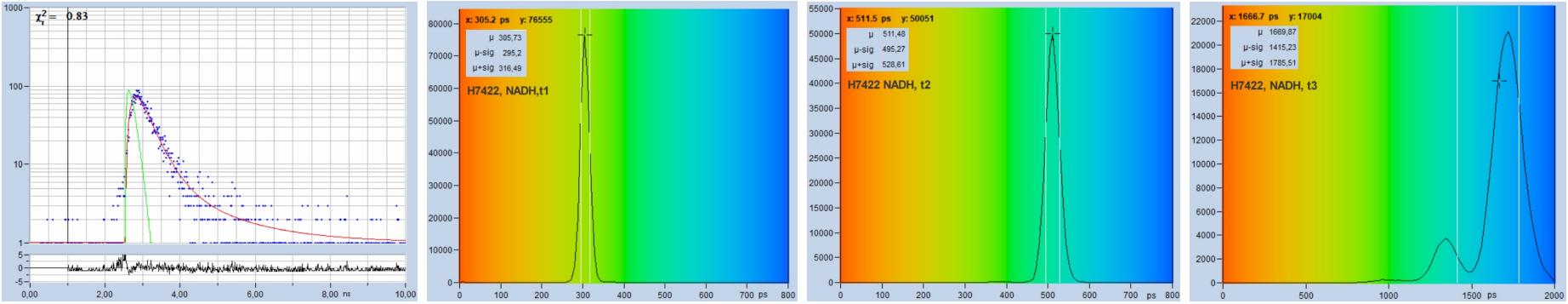
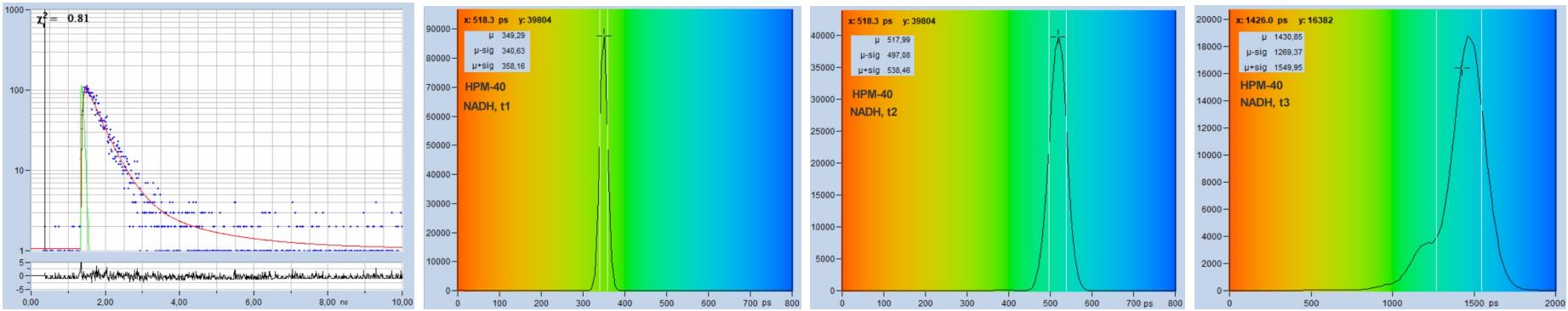
圖28和圖29給出了多指數衰減測量的示例。圖28顯示了NADH溶液的FLIM數據。使用溶液獲得在整個掃描區域均勻的壽命分布。然后,像素上的參數直方圖由光子噪聲決定,而不是由掃描區域的壽命變化決定。在785 nm處用雙光子激發記錄數據,用512 x 512像素,1024個時間通道掃描圖像。從上到下,圖28顯示了使用H7422-40 PMT探測器以及HPM-100-40和HPM-100-06混合探測器記錄的數據。IRF 寬度分別為 250 ps、110 ps 和 18 ps。從左到右,該圖顯示了任意選定點的衰減曲線、快速分量 t1 的壽命直方圖、第二快分量 t2 的直方圖和慢分量 t3 的直方圖。
可以清楚地看到,隨著IRF寬度的減小,壽命直方圖變得更窄。有趣的是,這不僅適用于快速分量,也適用于中慢分量。使用 HPM-100-06 獲得最佳結果,即 IRF 寬度為 18 ps。使用如此快速的IRF記錄的衰減數據幾乎不受IRF引起的計時抖動的影響。HPM-100-06的t1、t2 和 t3 的直方圖比 H7422 窄 1.4 倍,這意味著它的光子效率高出2倍。
 |
 |
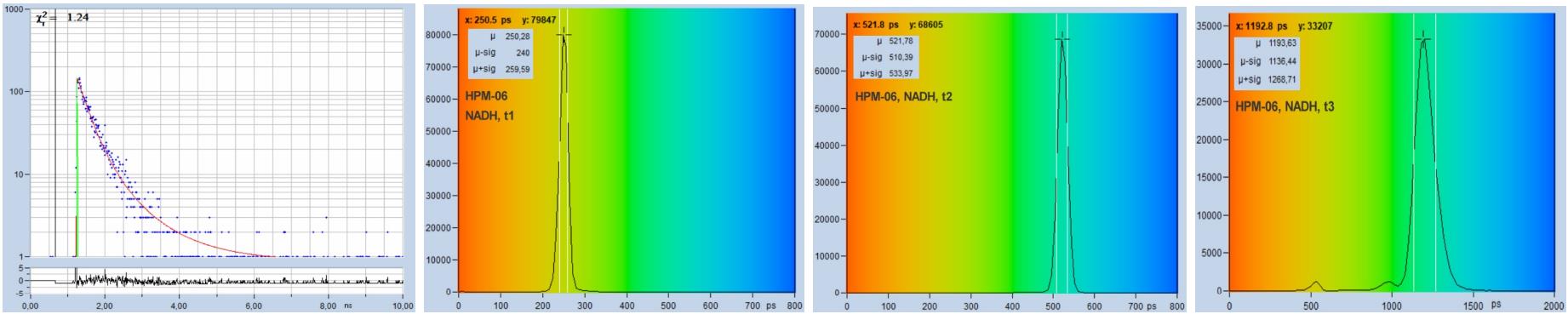 |
圖28:NADH溶液,用不同探測器記錄的數據。上排:H7422-40探測器,IRF寬度250 ps。第二排:HPM-100-40,IRF 寬度 110 ps。下排:HPM-100-06,IRF 寬度 18 ps。從左到右:任意選定點的衰減曲線,快速分量的直方圖,t1,第二快分量的直方圖,t2,慢分量的直方圖,t3。雙光子激發,非解掃描探測,圖像512×512像素,1024個時間通道,約5000個光子在合并區域里。
圖29給出了對壽命低于25ps的超快衰減分量探測的示例。這種快速分量很常見,我們經常在人類的頭發,蘑菇孢子和哺乳動物皮膚的痣中發現它們。在黃素腺嘌呤二核苷酸(FAD)的熒光衰減中也存在一種快速分量,FAD是一種存在于每個細胞中的天然熒光團。FAD很重要,因為它的熒光衰減函數包含有關細胞代謝狀態的信息。
圖29顯示了FAD溶液的FLIM圖像。從左到右,該圖顯示了快速衰減分量 t1、三重指數擬合的衰減曲線和 t1 直方圖的圖像。上行的數據用HPM-100-40探測器記錄,下排的數據用HPM-100-06記錄。從視覺上看,HPM-100-40(IRF 110 ps FWHM)記錄的衰減曲線沒有顯示出快速分量的痕跡。但是,仔細的數據分析會提取一個使用壽命約為20 ps的分量。除非明確搜索,否則不易發現。整個圖像上 t1 值的直方圖顯示在右側。
用HPM-100-06(IRF寬度18 ps FWHM)記錄的數據。衰減曲線令人信服地表明,快速分量確實存在。在圖像的選定位置進行數據分析,最快的分量的壽命為16.5 ps(其他兩個分量分別為2.2 ns和3.2 ns)。直方圖顯示最常見的 t1 值約為 16 ps。
正如對快速IRF所預期的那樣,直方圖比HPM-100-40的數據窄了近2倍。
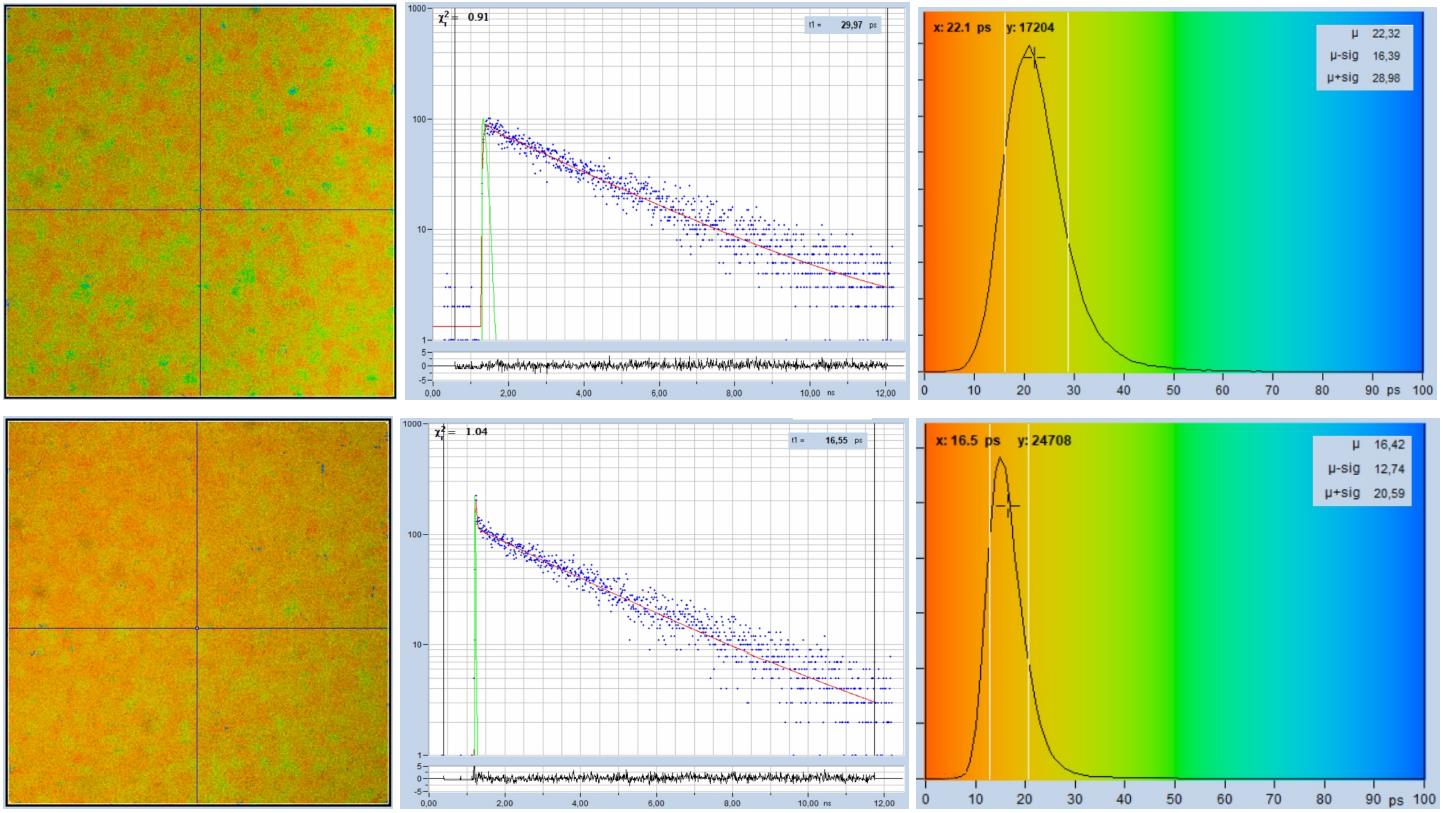
圖29:FAD溶液的熒光。從左到右:快速衰減分量t1的圖像,三重指數分析的衰減曲線,t1的直方圖。上排:用 HPM-100-40 探測器記錄,IRF 寬度 110 ps FWHM。下排:使用 HPM-100-06 探測,IRF 寬度 18 ps FWHM。
IRF 寬度 vs 探測器效率
應該注意的是,探測器的IRF寬度與探測效率之間存在潛在的取舍。快速探測器具有傳統的雙堿光陰極,因此,它們的靈敏度比GaAsP探測器低約4倍,但沒法知道更快的IRF和更高的靈敏度誰更重要。當然,為了解析超快衰減分量,沒有辦法繞過快速IRF,無論您是實際看到快速分量還是必須通過反卷積將其從數據中擠出。我們還發現,使用低于20ps的IRF對NADH和FAD數據的雙指數和三指數衰減分析更可靠,參考文獻[2,13],這也可以在圖28的底部看到。在實踐中,探測器的選擇取決于樣品的光穩定性。如果樣品在四倍的激發功率下或四倍的采集時間內依然保持穩定,則選擇快速IRF的探測器。反之,則必須使用GaAsP探測器。
References
1. W. Becker, Advanced time-correlated single-photon counting techniques. Springer, Berlin, Heidelberg, New York,2005
2. W. Becker, The bh TCSPC handbook, 8th edition. Becker & Hickl GmbH (2019), available online on www.becker-hickl.com. Please contact bh for printed copies.
3. SPCImage NG data analysis software. In: W. Becker, The bh TCSPC handbook, 8th edition. Becker & Hickl GmbH(2019)
4. W. Becker (ed.), Advanced time-correlated single photon counting applications. Springer, Berlin, Heidelberg, New York (2015)
5. Becker & Hickl GmbH, DCS-120 Confocal and Multiphoton Scanning FLIM Systems, user handbook 87th ed. (2019).?Available on www.becker-hickl.com
6. Becker & Hickl GmbH, Modular FLIM systems for Zeiss LSM 510 and LSM 710 family laser scanning microscopes.?User handbook. Available on www.becker-hickl.com
7. Becker & Hickl GmbH, FLIM systems from Zeiss LSM 980 Laser scanning microscopes, addendum to modular FLIM?systems for Zeiss LSM 510 and LSM 710 family laser scanning microscopes. Available on www.becker-hickl.com
8. Fast-Acquisition TCSPC FLIM: What are the Options? Application note, available from www.becker-hickl.com
9. W. Becker, V. Shcheslavkiy, S. Frere, I. Slutsky, Spatially Resolved Recording of Transient Fluorescence-Lifetime?Effects by Line-Scanning TCSPC. Microsc. Res. Techn. 77, 216-224 (2014)
10. R.M. Ballew, J.N. Demas, An error analysis of the rapid lifetime determination method for the evaluation of single?exponential decays, Anal. Chem. 61, 30 (1989)
11. W. Becker, B. Su, K. Weisshart, O. Holub, FLIM and FCS Detection in Laser-Scanning Microscopes: Increased?Efficiency by GaAsP Hybrid Detectors. Micr. Res. Tech. 74, 804-811 (2011)
12. Wolfgang Becker, Cornelia Junghans, Axel Bergmann, Two-photon FLIM of mushroom spores reveals ultra-fast decay component. Application note, available on www.becker-hickl.com.
13. Becker & Hickl GmbH, Ultra-fast HPM detectors improve NADH FLIM. Application note, www.becker-hickl.com
14. Becker & Hickl GmbH, Two-Photon FLIM with a Femtosecond Fibre Laser. Application note, www.becker-hickl.com
15. Becker Wolfgang, Suarez-Ibarrola Rodrigo, Miernik Arkadiusz, Braun Lukas, Metabolic Imaging by Simultaneous?FLIM of NAD(P)H and FAD. Current Directions in Biomedical Engineering 5(1), 1-3 (2019)
16. H.C. Gerritsen, M.A.H. Asselbergs, A.V. Agronskaia, W.G.J.H.M. van Sark, Fluorescence lifetime imaging in?scanning microscopes: acquisition speed, photon economy and lifetime resolution, J. Microsc. 206, 218-224 (2002)
17. M. K?llner, J. Wolfrum, How many photons are necessary for fluorescence-lifetime measurements?, Phys. Chem. Lett.?200, 199-204 (1992)
18. I. Isenberg, R.D. Dyson, The analysis of fluorescence decay by a method of moments. Biophys. J. 9, 1337-1350 (1969)
